



特点:
得到单细胞水平上反映细胞生理功能的各种细胞内特征的海量数据。
采用免洗一步染料标记法,操作简单、实时检测、 结果准确。
使用高通量/高内涵检测的方法,获得海量数据,进行大数据比对分析,建立网络集成
式细胞内特征的公共数据库,为人类对疾病的了解、新药研发及个性化治疗提供有力的数据支撑和手段。
美国国立卫生研究院NIH 正在进行的建立网络集成式细胞内特征的公共数据库(LINCS)项目,旨在开发细胞水平上药物特性的生物学标签,通过监视细胞内表型的变化动态反映药物作用机制,使我们能迅速了解个体细胞的药物功能基因组学和药物代谢组学的特征。
Cellarium ( A Live-Cell Microarray for High-Throughput Observation of MetabolicBiosignatures) 技术是以NIH NHGRI (National Human Genome Research Institute)CEGS(Centerof Excellence in Genomic Sciences)Microscale Life Sciences Center 开发的技术衍生出来的,隶属于上述NIH LINCS 项目的一部分。这种技术通过单细胞代谢分析,致力于开发单细胞水平的药物特性的代谢图谱。The LINCS Tech U01 可以支持新一代高通量系统的发展并将数据储存到LINCS 数据库中。利用ImageXpress® Micro 高内涵分析系统可实现快速的高分辨率图像采集,以得到单细胞水平上反应细胞各种生物特征的数据分析和处理。
在美国NIH LINCS 项目中,利用高内涵成像分析技术平台可获得单个细胞水平的各种生物学特征,如固定细胞中蛋白的免疫检测、活细胞凋亡图像分析、蛋白激酶生化分析以及细胞活力相关的生理参数,为研究者和临床诊断医生探测单细胞个体分析和如何用药提供了一个独特的工具。
流程图

图1 概括了cellarium 技术的工作流程。首先,将细胞种到微孔中并在正常条件下进行培养(在孵育之前,要先加入实验需要的各种刺激因子)。将传感器微阵列压在细胞微孔阵列上后,就完成了单细胞分离和密封的步骤了。然后,在一个精确的时间段内对芯片进行高速扫描就可以得到相应的参数包括耗氧率,胞外pH 变化以及糖摄取状况等。这些数据与癌细胞代谢,正常细胞生长发育以及一系列的人类疾病相关。此外,胞内的荧光传感器可以扩大检测参数的范围,其中包括ATP 等,通过高内涵图像采集及分析系统将单细胞荧光图像存储并分析,得到大量单细胞生理参数。这些数据被整理并上传到LINCS 公共数据库中,供所有的研究者查阅。
分离单细胞传感器微阵列
传统的大量细胞群体的生理特征测量只是细胞对刺激的平均反应,科研工作者们希望测量单个细胞水平上的生理参数,以研究细胞代谢、异质性及疾病发生早期。近期研究的单细胞代谢大部分基于荧光传感器系统,因为这种系统是非侵入性的、一次性的、可远程遥控的测量生化参数的方法。
应用化学方法可成功制造出各种尺寸的的圆点传感器,小至3 微米,且成功率超过90%(图2)。以耗氧率传感器为例,设计出了“lid-on-top”样式的微室,微室顶部的“lid”部分按已设计好的图案放置传感器;细胞生长于微孔底部,微孔的直径是固定的,在50-100 微米之间,因此放置传感器的图形要经过精确的计算以达到高信噪比。“lid”部分安放在PDMS(polydimethylsiloxane)材料的活塞上,盖上活塞时机械力可在包含传感器的”lid”和芯片底部的细胞之间产生密封效果。当光从芯片下方照射时,测量并记录传感器激发强度,且此强度与微室中氧浓度有对应关系,经过计算就可得到氧气浓度(图3)。

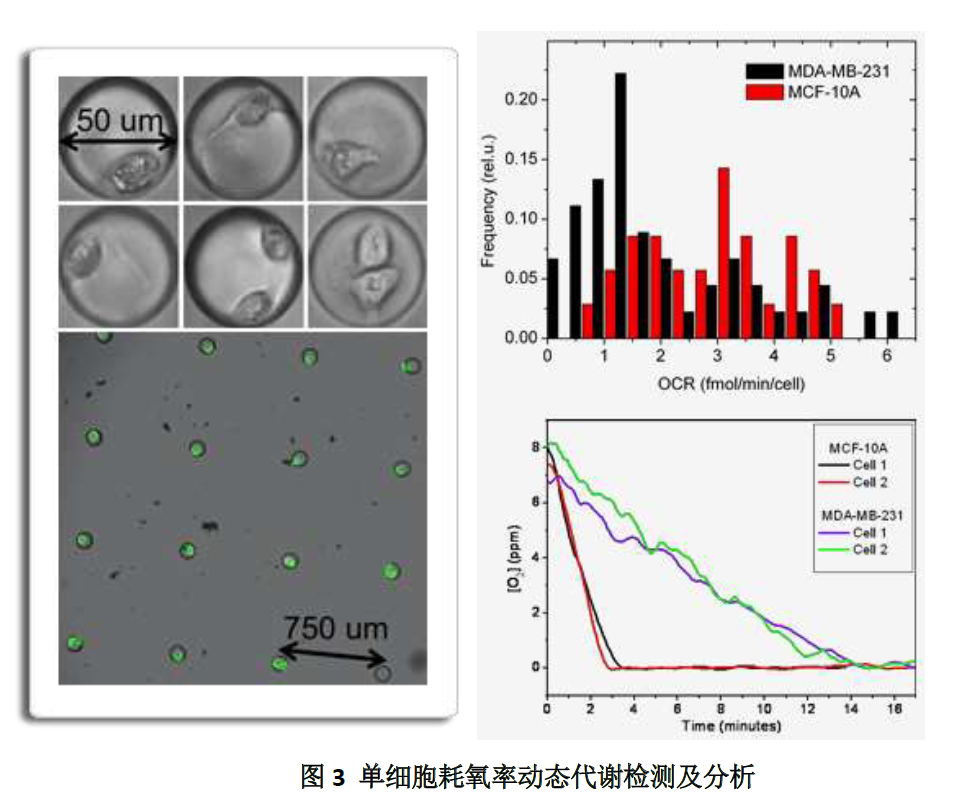
一步染色法检测细胞对药物的敏感性
应用ImageXpress® Micro 高内涵成像系统可快速、方便、高通量的测量细胞对小分子药物的多参数生理变化,并且使用三种荧光染料对活细胞进行染色,只需一步,无需清洗,对于贴壁性不好的有丝分裂细胞和凋亡细胞,这种方法比传统的基于免疫荧光染色的方法更加准确。应用此法得到的数据已经上传到NIH 的LINCS 公共数据库中(http://lincs.hms.harvard.edu/)。
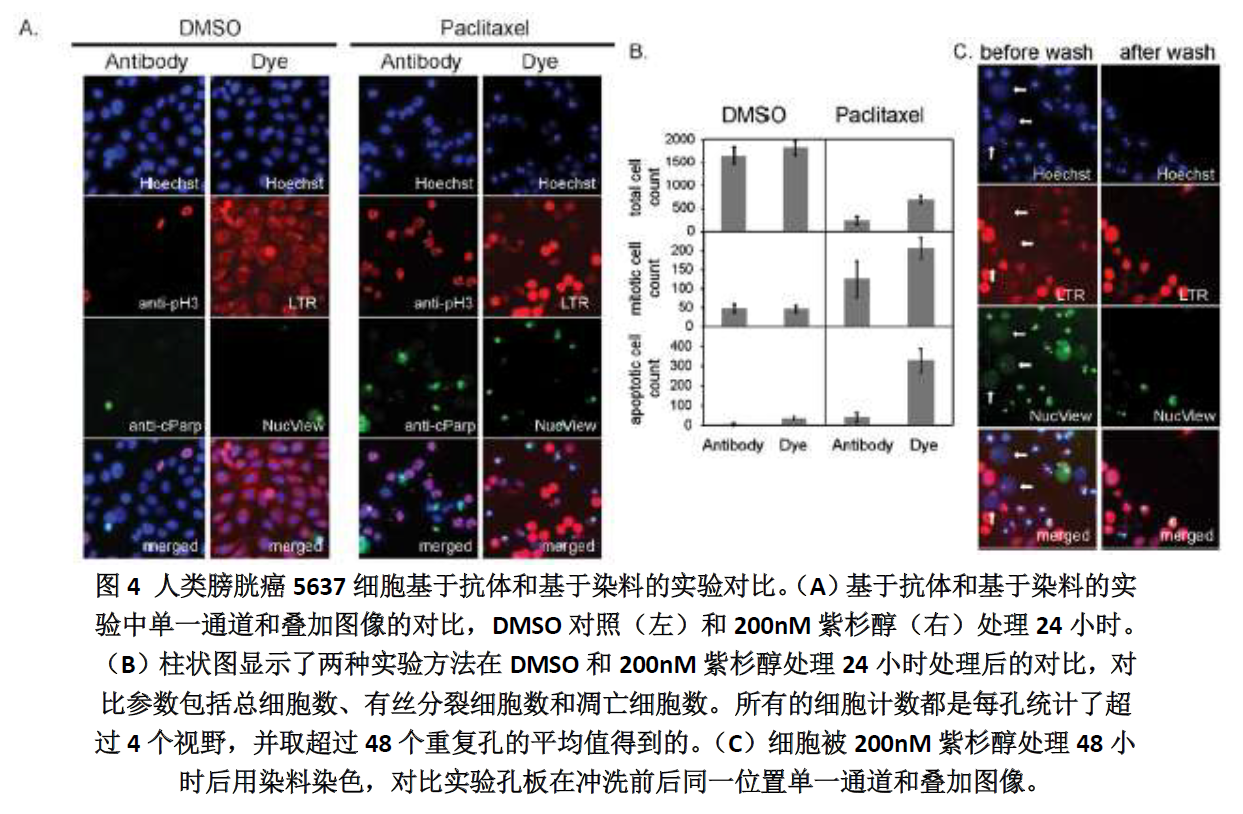
在传统免疫荧光法和一步荧光染料法的对比实验中,免疫荧光法用phospho(Ser10)Histone H3 标记有丝分裂细胞,antcleaved PARP1 标记凋亡细胞。染料法用LysoTracker-Red显示细胞形态,DEVDNucView488 caspase-3 标记凋亡细胞。两种方法均用Hoechst 33342 标记细胞核。免疫荧光法是将细胞固定后进行抗体染色步骤,包括冲洗板子,而荧光染料法是染色后再固定细胞,并且在采集图像前没有冲洗的步骤。
实验中用典型的抗有丝分裂药物紫杉醇处理人膀胱癌5637 细胞(图4)。在无药物的对照组,这两种实验方法的结果十分相近,包括细胞密度、细胞核形态、%有丝分裂、%凋亡细胞。在紫杉醇处理24 小时后,两种实验方法中的有丝分裂细胞数均显示出明显增加。但是,凋亡细胞数在免疫荧光法中明显少于荧光染料法。这说明免疫荧光法冲洗板子的过程虽然可以有效的保留有丝分裂细胞,但会使凋亡细胞损失。为了证明这一结论,我们用紫杉醇处理细胞48 小时后,用荧光染料法染色,先按正常程序不冲洗,采集下图像后,再用PBS冲洗三次模拟免疫荧光法,采集同样位置的图像,冲洗前后的图像对比如图4C 所示。冲洗后,NucView488 阳性细胞大量减少,另外,洗前的图像中有很多圆形、胀大、模糊的被LysoTracker-Red 和NucView488 染色很弱的核,而在冲洗后这些核完全丢失了。从细胞形态及染色情况看,这些应属于晚期凋亡细胞。
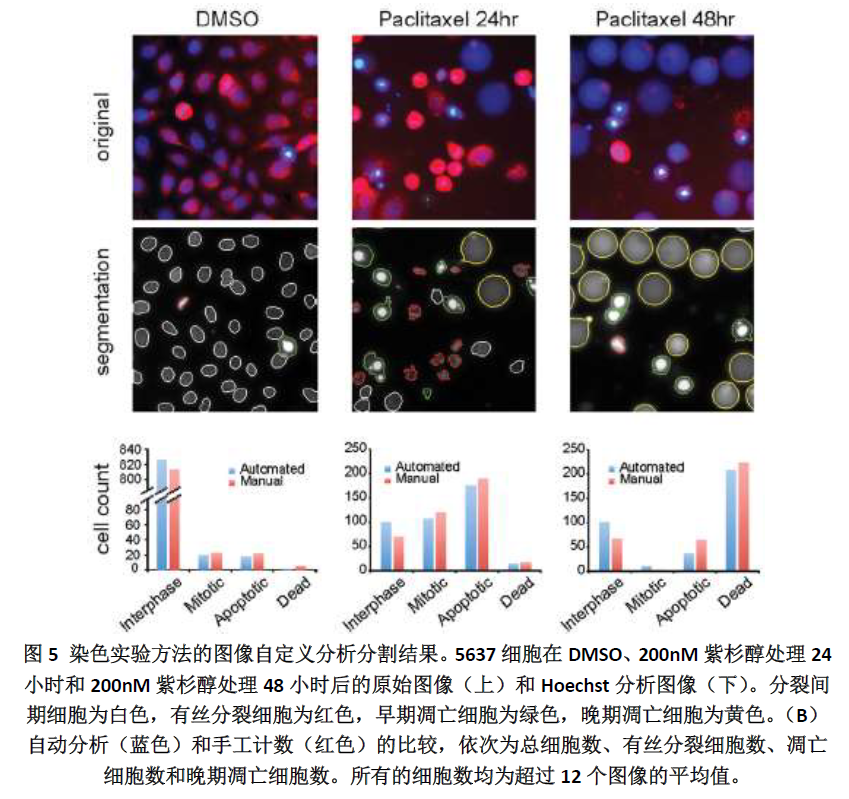
接下来我们评估了荧光染色高内涵法的自动表型算法(图5)。5637 细胞分别经过DMSO、200nM 紫杉醇处理24 小时、200nM 紫杉醇处理48 小时。不同表型的细胞被不同颜色轮廓标记出来:分裂间期细胞为白色,有丝分裂细胞为红色,早期凋亡细胞为绿色,晚期凋亡细胞为黄色。为了评估自动分析的准确性,我们从每种处理中随意挑选了12 张图片进行手动计数,作为标准与自动分析结果进行比较。结果显示两种计算方法非常相近,虽然自动分析中间期细胞数量略高,有丝分裂和凋亡细胞数量略低,但是误差很小,并不影响药物评价。
单细胞分析的未来
目前科学界认为,如果能深入了解单细胞的行为以及它们和微环境的相互作用,就能衍生出很多具有冲击性的发现。从近来的综述性文章我们可以发现,研究单细胞分析技术尤其是从传统细胞研究方法向高通量单细胞分析方法转变是必要的。
LINCS 项目不仅拥有全新的高通量平台测序技术及平台,包括ImageXpress® Micro 高内涵成像分析系统等,使之可以准确找到如单细胞代谢率的生物学标签的实时信号改变;更重要是在于对进行大规模数据库的建立和大数据的分析,使我们在后基因组时代进一步加快了转录组学、蛋白组学及单细胞代谢组学等的发展。LINCS 技术得到的海量数据信息和分析比对结果将极大影响人类对生命科学的研究及对人类疾病的了解,从而进一步改善人类的环境、医疗及健康状况。与此同时,也为制药/诊断公司提供了一个商业契机,可以利用LINCS 技术平台为研究者或临床医生提供更为准确可靠的生物学数据或个性化的诊断数据。
 2001-2009Vogel Industry Media版权所有 京ICP备12020067号-15 京公网安备110102001177号
2001-2009Vogel Industry Media版权所有 京ICP备12020067号-15 京公网安备110102001177号
评论
加载更多